Il ciclo di Krebs, detto anche ciclo degli acidi tricarbossilici (TCA) o ciclo dell’acido citrico, deve il nome al suo scopritore Hans Krebs, il quale, nel 1937, mentre lavorava presso l’Università di Sheffield, ne identificò le caratteristiche. Per questa sua scoperta, Krebs fu insignito del premio Nobel per la medicina nel 1953.
Negli organismi aerobici, il ciclo di Krebs è l’anello di congiunzione delle vie metaboliche responsabili del catabolismo dei carboidrati, dei grassi e delle proteine, in anidride carbonica e acqua.
Prima di poter entrare nel ciclo, lo scheletro carbonioso degli zuccheri, degli acidi grassi e di molti aminoacidi deve essere degradato e trasformato in acetil-CoA, una molecola formata da un gruppo acetile (CH3CO) e da un trasportatore di acili, detto coenzima A; altri amminoacidi sono, invece, degradati in intermedi del ciclo diversi dall’acetil-CoA.
Il ciclo di Krebs è una via metabolica anfibolica, in quanto comprende sia processi anabolici che catabolici. Infatti, non soltanto agisce nel catabolismo ossidativo dei carboidrati, degli acidi grassi e degli amminoacidi, ma produce anche precursori per molte vie biosintetiche. Ad esempio, l’α-chetoglutarato e l’ossalacetato vengono sottratti al ciclo dell’acido citrico per essere utilizzati come precursori degli amminoacidi aspartato e glutammato.
Il ciclo di Krebs produce una sola molecola di ATP, ma vengono liberati molti elettroni che sono poi trasferiti dal NADH e dal FADH2 alla catena respiratoria, determinando la produzione di un gran numero di molecole di ATP mediante la fosforilazione ossidativa. In particolar modo, Il ciclo dell’acido citrico produce 3 molecole di NADH e 1 di FADH2.
La reazione netta è la seguente:
acetil-CoA + 3 NAD+ + FAD + ADP + Pi + 2 H2O → CoA + 3 NADH + 3 H+ + FADH2 + ATP + 2 CO2
Il ciclo TCA e la fosforilazione ossidativa avvengono in organelli specializzati chiamati mitocondri (1).
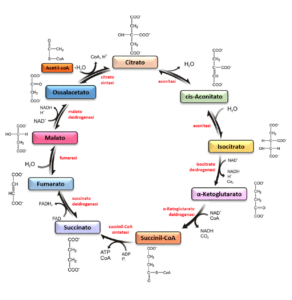
Reazioni del ciclo dell’acido citrico (Fig. 1)
- Formazione del citrato. La prima reazione irreversibile del ciclo, catalizzata dalla citrato sintasi, è la condensazione dell’acetil-CoA con l’ossalacetato per formare citrato. In questa reazione, l’atomo di carbonio metilico del gruppo acetilico si lega al gruppo carbonilico dell’ossalacetato. Il citril-CoA, un intermedio transitorio che si forma sul sito attivo dell’enzima, va incontro ad una rapida idrolisi, producendo CoA libero e citrato (1).
- Formazione dell’isocitrato. L’enzima aconitato idratasi catalizza la trasformazione reversibile del citrato a isocitrato. Viene prima rimossa una molecola d’acqua dall’acido citrico che forma l’intermedio cis-aconitato (reazione di disidratazione); il cis-aconitato viene poi reidratato per formare isocitrato. L’effetto complessivo di questa conversione è che il gruppo -OH viene spostato dalla posizione 3′ (citrato) alla posizione 4′ (isocitrato) della molecola (2).
- Ossidazione dell’isocitrato ad α-chetoglutarato e CO2. L’enzima isocitrato deidrogenasi catalizza l’ossidazione dell’isocitrato a ossalosuccinato, generando una molecola di NADH a partire da NAD+. Uno ione Mn2+ presente nel sito attivo dell’enzima, interagisce con il gruppo carbonilico dell’intermedio ossalosuccinato che viene, quindi, decarbossilato per formare α-chetoglutarato (1).
- Ossidazione dell’α-chetoglutarato a succinil-CoA e CO2. L’enzima α-chetoglutarato deidrogenasi catalizza una reazione di decarbossilazione ossidativa dell’α-chetoglutarato che viene convertito in succinil-CoA e CO2, attraverso la riduzione di NAD+ a NADH + H+ e la produzione di un legame tioestere ad alta energia con il coenzima A (2).
- Conversione del succinil-CoA a succinato. L’enzima succinil-CoA sintetasi catalizza una reazione di fosforilazione, in cui un gruppo fosfato libero si lega al succinil-CoA, rilasciando il CoA (idrolisi) e generando un intermedio succinilfosfato. In una reazione di condensazione successiva, il fosfato viene trasferito al GDP per formare GTP e succinato (1,2).
- Ossidazione del succinato a fumarato. L’enzima succinato deidrogenasi catalizza la reazione di ossidazione del succinato a fumarato, in cui il FAD, legato covalentemente all’enzima, viene ridotto a FADH2. Questo è l’unico enzima del ciclo ad essere coinvolto anche nella catena di trasporto degli elettroni (2).
- Idratazione del fumarato a malato. L’idratazione reversibile del fumarato a L-malato è catalizzata dalla fumarasi (fumarato idratasi) (1).
- Ossidazione del malato a ossalacetato. Nella reazione finale del ciclo dell’acido citrico, catalizzata dalla L-malato deidrogenasi, viene rigenerato l’ossalacetato mediante l’ossidazione dell’L-malato con una molecola di NAD+ , con produzione di NADH + H+ (2).
Regolazione del ciclo di Krebs
La velocità del ciclo dell’acido citrico è controllata:
- dalla velocità di conversione del piruvato derivante dalla glicolisi in acetil-CoA. Questo processo, catalizzato dalla piruvato deidrogenasi, è inibito dai metaboliti che segnalano una sufficiente disponibilità di energia metabolica (ATP, acetil-CoA, NADH e acidi grassi), e attivato di metaboliti che segnalano una ridotta disponibilità energetica (AMP, NAD+, CoA) (1).
- dal flusso attraverso la citrato sintasi, l’isocitrato deidrogenasi e l’α-chetoglutarato deidrogenasi. Il flusso attraverso questi enzimi è determinato dalla concentrazione dei substrati e dei prodotti: i prodotti terminali ATP e NADH sono inibitori, mentre i substrati NAD+ e ADP sono attivatori.
Ciclo di Krebs e diabete (Fig. 2)
Nel diabete non trattato, l’insulina è presente in quantità insufficienti e i tessuti extraepatici non possono captare il glucosio dal sangue per usarlo come combustibile o per convertirlo in acidi grassi di riserva. In queste condizioni, l’enzima acetil-CoA carbossilasi, che normalmente converte l’acetil-CoA derivante dal metabolismo del glucosio in malonil-CoA, punto di partenza per la sintesi degli acidi grassi, non è attivo. In assenza di glucosio, la beta-ossidazione degli acidi grassi rappresenta la principale fonte di produzione dell’energia. Inizialmente, gli acidi grassi vengono degradati ad acil-CoA, il quale viene trasportato all’interno dei mitocondri ad opera della carnitina-aciltransferasi (CAT) 1 e 2. Il malonil-CoA normalmente inibisce l’azione della CAT1, quindi la sua mancata produzione favorisce questo trasporto. Nei mitocondri, la beta-ossidazione porta alla formazione di acetil-CoA, che però non può essere ossidato attraverso il ciclo dell’acido citrico, in quanto alcuni intermedi del ciclo stesso sono stati sottratti per la gluconeogenesi. L’accumulo di acetil-CoA provoca una produzione di corpi chetonici in quantità superiori alle capacità degli organi extraepatici di utilizzarli. La sovrapproduzione di corpi chetonici, condizione detta anche chetosi, porta ad un forte aumento di questi composti nel sangue (chetonemia) e nelle urine (chetonuria) (1).
Bibliografia
- Davide L.Nelson, Michael M. Cox, I principi di Biochimica di Lehninger, Stati Uniti, W.H. Freeman and Company, 2008, pp. 618-633, 641, 672. ISBN 978-88-08-06403-5
- The citric acid cycle http://www.sparknotes.com/biology/cellrespiration/citricacidcycle/section2