Sensibilità all’insulina whole-body e calorimetria
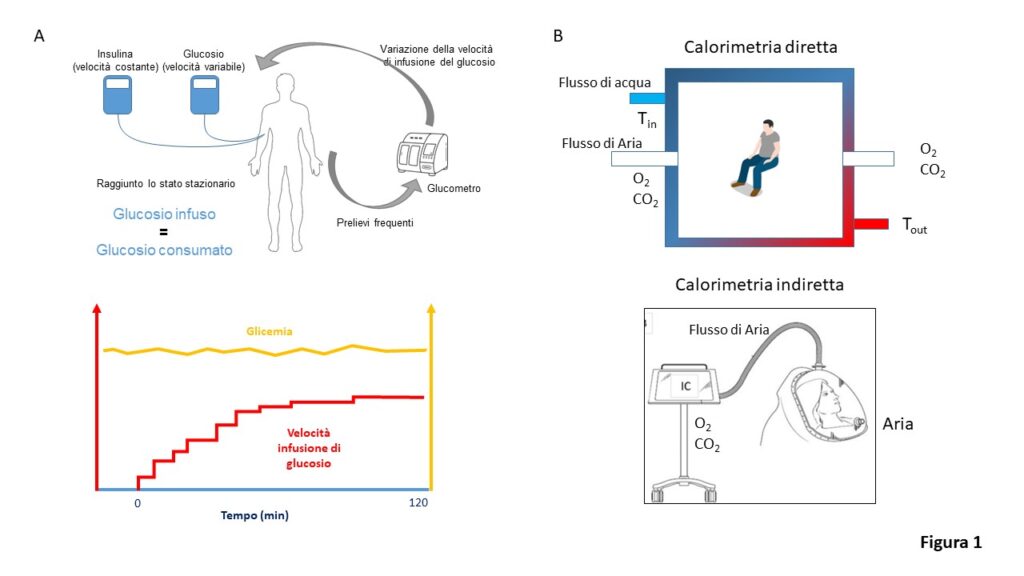
Con il termine “sensibilità insulinica” a livello di organismo in toto, si intende la capacità dell’insulina, a concentrazioni fisiologiche post-prandiali, di promuovere l’utilizzazione sistemica di glucosio che essenzialmente ha luogo nel muscolo scheletrico ed, in minor misura, nel tessuto adiposo. La tecnica di riferimento per la sua misura è rappresentata dal clamp euglicemico iperinsulinemico (1). Durante il clamp si misura la velocità con cui deve essere infuso glucosio e.v. (GIR) per mantenere la glicemia stabile (“clampata”) a valori normali (tipicamente a 80-100 mg/dl) nonostante una contemporanea infusione e.v. di insulina a velocità costante (calcolata per portarne la concentrazione a valori intorno a 500 pmol/L, Figura 1A).
Più alta è la GIR, maggiore l’insulino sensibilità. Raggiunto lo stato stazionario (circa 2 ore), il consumo di glucosio viene calcolato su un intervallo di circa 40 minuti correggendo la GIR media per la variazione di glicemia (M) (1). Il rapporto tra M e la concentrazione insulinica raggiunta (“M/I”) è l’indice più affidabile di sensibilità all’insulina. Per ovviare ai limiti del clamp euglicemico, dispendioso e tecnicamente complesso, sono stati elaborati indici surrogati di sensibilità insulinica (o del suo opposto, l’insulino-resistenza) che utilizzano le concentrazioni ematiche di insulina e glucosio a digiuno (es HOMA-IR, QUICKI) oppure derivanti da test dinamici quali il test di tolleranza ad un carico orale di glucosio, OGTT (es. Matsuda index, OGIS) (2).
La calorimetria è il metodo di riferimento per misurare la spesa energetica e si distingue in diretta o indiretta (Figura 1B).
La calorimetria diretta misura la quantità di calore prodotta da un soggetto posto in una camera isolata (camera calorimetrica) insieme alla produzione di anidride carbonica e l’utilizzazione di ossigeno. La calorimetria indiretta, più semplice ed economica, misura solo gli scambi gassosi. Se a questi parametri si aggiunge una stima della ossidazione proteica (ad es. azoto urinario) è possibile calcolare con apposite equazioni la miscela di substrati ossidati ed anche stimare il consumo di calorie (3). Nonostante sia necessario una condizione di stato stazionario, è possibile eseguire la misura anche in condizioni dinamiche (clamp, OGTT, esercizio) dal momento che il ritardo tra metabolismo e scambi gassosi è di pochi minuti. La spesa energetica a riposo può essere stimato mediante apposite formule (es. Harris-Benedict), che si basano su semplici parametri quali sesso, età, peso e altezza.
Uptake e metabolismo del glucosio negli organi/tessuti
L’uptake del glucosio, come anche degli altri metaboliti, da parte degli organi o tessuti può essere misurato mediante la tecnica dei bilanci artero-venosi oppure la tomografia ad emissione di positroni (PET).
Per la prima occorre avere un accesso arterioso ed un accesso venoso del sangue refluo dall’organo ed occorre misurare il flusso ematico nello stesso distretto ed il volume del tessuto. Mediante la formula di Fick ((Ca-Cv) x flusso plasmatico) si ottiene il bilancio netto di organo (solitamente in μmol/100ml/min) (Figura 2A). Se il numero è positivo si tratta di uptake, se negativo di rilascio. Questa metodica è stata applicata al cuore, all’avambraccio, alla gamba, al tessuto adiposo sottocutaneo, al fegato ed al rene (4). Le metodiche impiegate per la misura del flusso sono molteplici (termodiluizione, pletismografia a strain gauge, diluizione di un tracciante intravascolare) e dipendono dall’esperienza del laboratorio e dalle caratteristiche anatomiche dell’organo preso in esame. Il pregio di questa metodica è che richiede una stabilità dei parametri primari di pochi minuti (5) e quindi consente anche di fare studi dinamici (ad esempio digiuno vs clamp euglicemico, oppure durante manipolazioni del flusso o delle concentrazioni dei substrati oppure, per il muscolo, l’esercizio) ed inoltre consente di misurare i bilanci di ossigeno e di altri metaboliti oltre al glucosio. Per studiare il metabolismo intracellulare del glucosio è necessario l’impiego di traccianti specifici che vanno in contro a diversi destini metabolici (solo trasporto trans membrana, trasporto e fosforilazione) (6).
La PET misura l’assorbimento tissutale (uptake) di glucosio nell’uomo in quanto il tracciante ([18F]FDG) viene trasportato all’interno della cellula e lì resta perché viene fosforilato, ma non metabolizzato. Durante la stessa sessione di uno studio PET, si può usare più di un tracciante, per esempio [15O2]H2O per valutare la perfusione, o [15O2]O2 per valutare l’uptake di ossigeno. Uno dei vantaggi della PET è che applicando scansioni su tutto il corpo durante un unico studio si può valutare il metabolismo di organi e tessuti (Figura 2B). I dati [18F]FDG-PET possono essere analizzati in vari modi utilizzando o metodi semi quantitativi, come SUV (standardized uptake value), o metodi di quantificazione; per questi ultimi è necessario misurare le concentrazioni del tracciante nel plasma (con frequenti prelievi venosi) e applicare modelli (come il Patlak plot, oppure il fractional uptake rate, FUR), ottenendo quindi valori in μmol/100ml/min (Figura 2C). La misura dura circa 60 min e può essere ripetuta (ad es. digiuno vs calmp). Ad oggi nell’uomo sono stati studiati gli uptake rate di quasi tutti i tessuti (muscolo, tessuto adiposo, encefalo, fegato, rene) evidenziando differenze significative fra soggetti insulino resistenti e insulino sensibili (7).

Flussi metabolici del glucosio
La concentrazione di glucosio nel sangue è determinata da tre distinti processi: la comparsa di glucosio dovuta ad assunzione orale (con pasti e bevande), la produzione endogena in larga misura da parte del fegato (via glicogenolisi e gluconeogenesi), e l’utilizzazione ad opera del sistema nervoso centrale, dei muscoli, del tessuto adiposo, e di altri tessuti, in cui il glucosio viene immagazzinato come glicogeno o metabolizzato. Conoscere le velocità di ciascuno dei tre processi, ossia i flussi, è essenziale per la comprensione della fisiopatologia dell’omeostasi del glucosio, ma la loro quantificazione è difficile, soprattutto in condizioni non stazionarie (ossia quando le quantità osservate variano nel tempo, come in un pasto). Il problema è affrontato usando i traccianti e l’analisi dello loro cinetica. Il tracciante è un indicatore che segue (“traccia”) il comportamento metabolico di una sostanza – il tracciato (in questo caso il glucosio) – all’interno di un organismo. Un tracciante ideale deve avere le stesse proprietà fisico-chimiche del tracciato, e deve essere introdotto nell’organismo in piccole quantità, tali da non creare perturbazioni. Il tracciante si distingue dal tracciato perché marcato con isotopi radioattivi o stabili. Il glucosio viene tipicamente tracciato con isotopi stabili dell’idrogeno (deuterio) e del carbonio (13C). Il rapporto tra utilizzazione e concentrazione plasmatica nei tessuti, ossia la clearance, è assunto uguale nel tracciante e nel tracciato, per definizione di tracciante ideale. Il tracciante non è soggetto a produzione endogena. In base a queste due considerazioni, l’utilizzazione di glucosio e la sua produzione in condizioni stazionarie si possono stimare con l’infusione intravenosa di un solo tracciante: il rapporto tra infusione e concentrazione di tracciante è la clearance e il prodotto della clearance per la concentrazione di tracciato è l’utilizzazione, che uguaglia la produzione. In condizioni non stazionarie, è necessario anche conoscere le leggi dinamiche della distribuzione del glucosio (e quindi dei suoi traccianti) nell’organismo. Per trattare questo aspetto, sono state proposte diverse rappresentazioni matematiche, con diversi gradi di empiricità ed aderenza alla fisiologia (8–10). La contemporanea determinazione della comparsa orale e della produzione endogena richiede l’utilizzo simultaneo di un secondo tracciante, aggiunto al glucosio ingerito (Figura 3).

Bibliografia
- DeFronzo RA, Tobin JD, Andres R. Glucose clamp technique: a method for quantifying insulin secretion and resistance. Am J Physiol 1979; 237(3):E214-23. doi: 10.1152/ajpendo.1979.237.3.E214.
- Otten J, Ahren B, Olson T. Surrogate measures of insulin sensitivity vs the hyperinsulinaemic-euglycaemic clamp: a meta-analysis. Diabetologia 2014; 57, 1781-1788. doi: 10.1007/s00125-014-3285-x.
- Ferrannini E. The theoretical bases of indirect calorimetry: a review. Metabolism 1998; 37(3), 287-301. doi: 10.1016/0026-0495(88)90110-2.
- Macdonald, I. (1999). Arterio–venous differences to study macronutrient metabolism: Introduction and overview. Proceedings of the Nutrition Society, 58(4), 871-875. doi:10.1017/S0029665199001172
- Zierler KL (1961) Theory of the use of arteriovenous concentration differences for measuring metabolism in steady and non-steady states. Journal of Clinical Investigation 40, 2111–2125.
- Bonadonna RC, Del Prato S, Bonora E, Saccomani MP, Gulli G, Natali A, Frascerra S, Pecori N, Ferrannini E, Bier D, Cobelli C, DeFronzo RA. Roles of glucose transport and glucose phosphorylation in muscle insulin resistance of NIDDM. Diabetes. 1996 Jul;45(7):915-25. doi: 10.2337/diab.45.7.915. PMID: 8666143.
- http://www.turkupetcentre.net/petanalysis/analysis_18f-fdg.html
- Mari A, Stojanovska L, Proietto J, Thorburn AW. A circulatory model for calculating non-steady-state glucose fluxes. Validation and comparison with compartmental models. Computer methods and programs in biomedicine. 2003;71(3):269–81.
- Steele R, Wall JS, De Bodo RC, Altszuler N. Measurement of size and turnover rate of body glucose pool by the isotope dilution method. Am J Physiol. 1956 Sep;187(1):15–24.
- Radziuk J, Norwich KH, Vranic M. Experimental validation of measurements of glucose turnover in nonsteady state. Am J Physiol. 1978 Jan;234(1):E84-93.

